Так вот ты какой, гомеостаз!
Published:
В процессе подготовки данных для анализа чувствительности пришлось насчитать более полумиллиона потоковых моделей метаболической сети E. coli. Каждая такая модель имела одинаковую структуру сети, но различные ограничения на скорости более 1100 обменных потоков, моделируя различные составы среды. Таким образом мы можем сравнить поведение метаболической системы бактерии в различных условиях доступности как существенных метаболитов, таких как источники углерода и азота, так и токсинов и лекарств.
Полученные результаты можно рассматривать как попытку проанализировать поведение бактерий в богатой среде. Ведь как было отмечено в работе Van Pelt-KleinJan с соавторами все современные метаболические модели построены на основании данных о росте бактерий в “контролируемой” среде, т.е. среде бедной не в плане доступности источников углерода или азота, а в плане разнообразия таких источников. Прямой перенос таких моделей в “богатую” среду, соответствующую, например, окружению кишечной палочки, находящейся в просвете кишечника, может приводить к заметному отклонению поведения модели от поведения реального организма. Вспомним, хотя бы, лактозный оперон, обеспечивающий невозможность метаболизма лактозы в присутствие других источников энергии. Одним из способов проверки правомочности такого переноса может быть вычисление решений модели в большом количестве “богатых сред”, характеризующихся разным уровнем доступности метаболитов, и анализ того, как полученные решения соотносятся с базовыми характеристиками поведения клетки.
Влияние доступности экзометаболитов на скорость роста бактерий рассмотрена в вышеуказаной статье, мы же сфокусируемся на поведении внутренних потоков в метаболической сети. Ключевой характеристикой метаболической сети является её способность поддерживать гомеостаз, т.е. постоянство внутренней среды организма. Чтобы оценить насколько сильно меняются величины внутренних потоков мы вычислили разброс (разницу максимального и минимального значения потока среди всех 500К соболевских точек) и число уникальных значений для всех 3277 потоков в модели. На следующем графике приведена гистограмма числа уникальных значений величины потока:
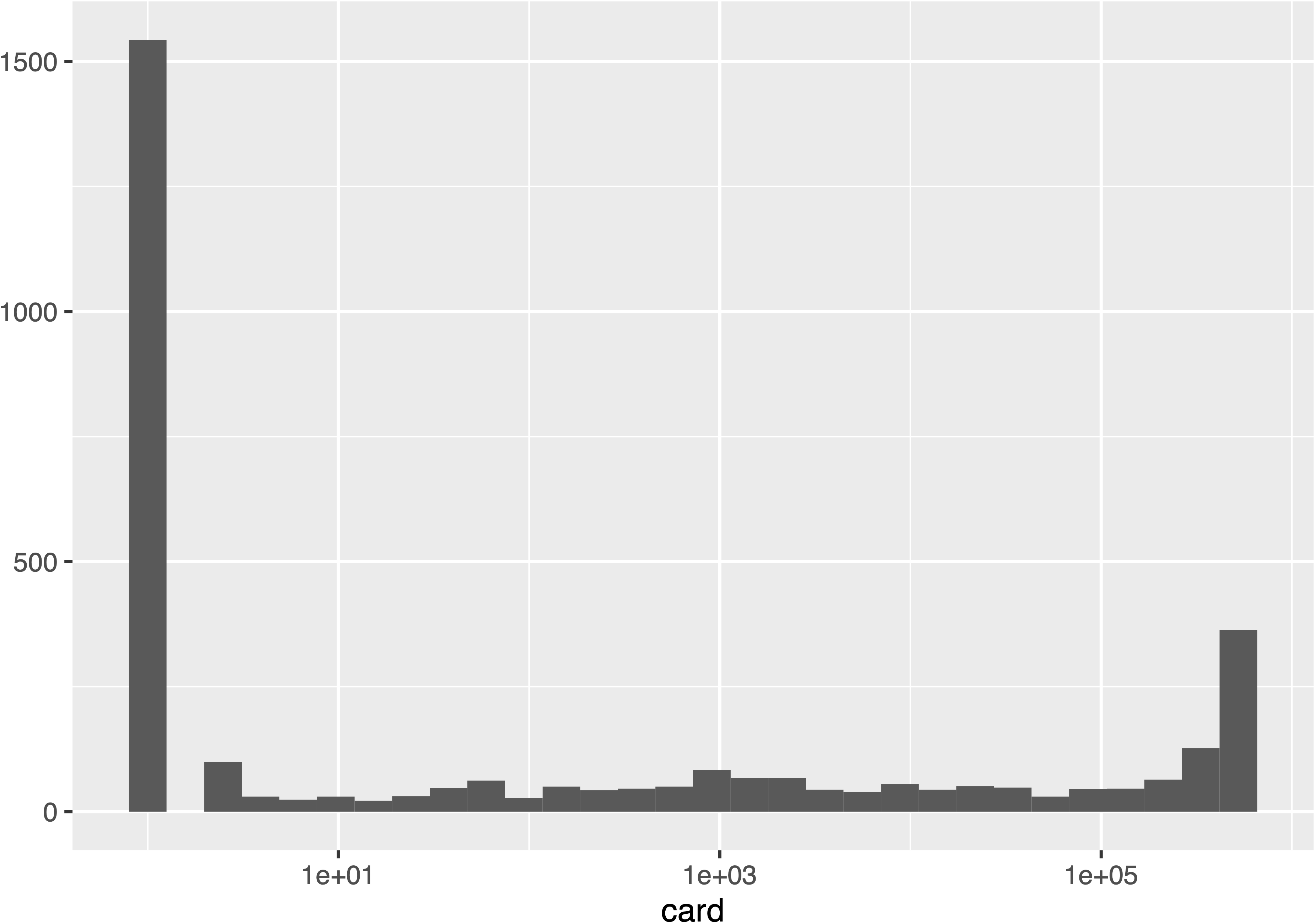
Видно что значительная часть (1543 или 47%) реакций заблокированы (всегда имеют только одно нулевое значение потока). В следующей таблице приведены наиболее часто встречающиеся метаболические подсистемы, в которых эти реакции участвуют:
| Subsystem | Freq |
|---|---|
| Transport, periplasmatic | 633 |
| Exchange/demand reaction | 302 |
| Drug metabolism | 137 |
| Glycerophospholipid metabolism | 106 |
| Fatty acid synthesis | 82 |
Видно, что большая часть заблокированных реакций относится к транспорту и, скорее всего связана с теми 594 параметрами, которые были исключены из расчетов коэффициентов чувствительности в исходной статье. Кроме того, очевидно, что если заблокирован транспорт метаболита, то и все последующие реакции с его участием тоже блокируются.
Однако вернемся к нашему гомеостазу и построили гистограмму значений разброса величины потока для незаблокированных реакций:
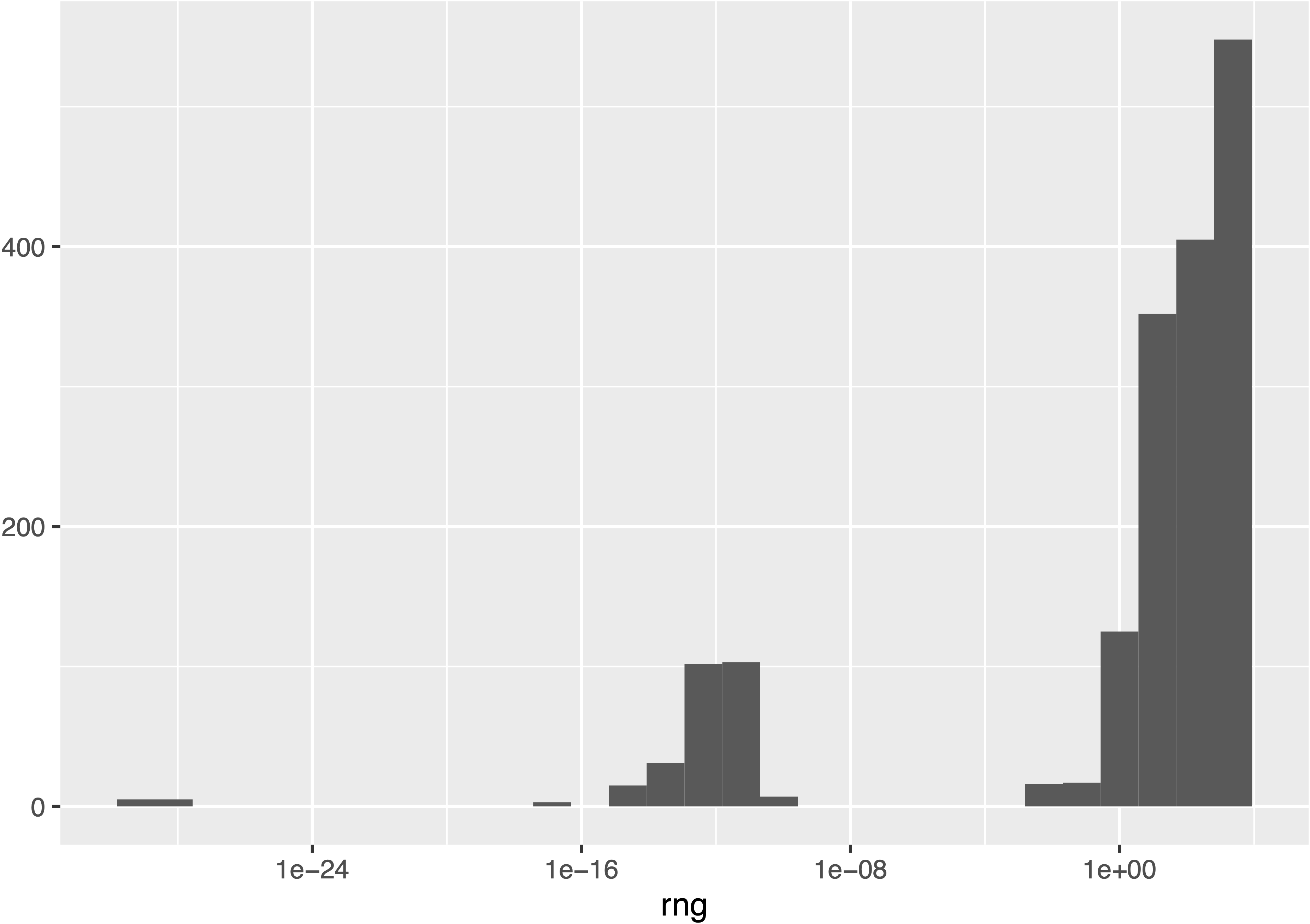
Видно что, несмотря на то, что большая половина потоков меняется довольно значительно, присутствует существенная часть, изменения которых достаточно малы, учитывая что значения границ обменных потоков менялись от -1000 до 1000. Можно условно считать, что именно те потоки, что формируют группы с разбросом менее $10^{-8}$ и составляют гомеостатическое ядро метаболической сети. Для того, чтобы найти такие потоки мы кластеризовали данные по разбросу с помощью алгоритма DBSCAN с параметрами $\epsilon = 10^{-5}$ и $minPts=10$. Получившийся набор кластеров представлен в следующей таблице:
| clE5 | N | min | q1 | med | mean | q3 | max | iqr | range |
|---|---|---|---|---|---|---|---|---|---|
| 0 | 1239 | 0.213 | 37.4 | 376 | 575 | 978 | 2000 | 941 | 2000 |
| 1 | 271 | 4.79e-30 | 1.51e-13 | 7.07e-13 | 3.84e-12 | 5.11e-12 | 3.54e-11 | 4.96e-12 | 3.54e-11 |
| 2 | 57 | 1000 | 1000 | 1000 | 1000 | 1000 | 1000 | 2.17e-11 | 1.01e-10 |
| 3 | 21 | 30.7 | 30.7 | 30.7 | 30.7 | 30.7 | 30.7 | 1.42e-14 | 5.33e-14 |
| 4 | 20 | 39 | 39 | 39 | 39 | 39 | 39 | 2.07e-12 | 4.73e-12 |
| 5 | 32 | 0.956 | 0.956 | 0.956 | 0.956 | 0.956 | 0.956 | 1.11e-16 | 7.77e-16 |
| 6 | 15 | 0.0808 | 0.0808 | 0.0808 | 0.0808 | 0.0808 | 0.0808 | 3.58e-13 | 1.47e-11 |
| 7 | 13 | 7.32 | 7.32 | 7.32 | 7.32 | 7.32 | 7.32 | 8.88e-16 | 4.31e-12 |
| 8 | 15 | 11.3 | 11.3 | 11.3 | 11.3 | 11.3 | 11.3 | 1.78e-15 | 3.55e-15 |
| 9 | 16 | 0.0119 | 0.0119 | 0.0119 | 0.0119 | 0.0119 | 0.0119 | 3.68e-12 | 2.3e-09 |
| 10 | 10 | 6.13 | 6.13 | 6.13 | 6.13 | 6.13 | 6.13 | 8.88e-16 | 2.66e-15 |
| 11 | 12 | 1.91 | 1.91 | 1.91 | 1.91 | 1.91 | 1.91 | 2.33e-13 | 2.77e-13 |
| 12 | 13 | 3.07 | 3.07 | 3.07 | 3.07 | 3.07 | 3.07 | 4.44e-16 | 8.88e-16 |
, где
- clE5 – номер кластера;
- N – число реакций в кластере;
- min – минимальное значение разброса величины потока;
- q1 – первый квартиль значение разброса величины потока;
- med – медиана значение разброса величины потока;
- mean – среднее значение разброса величины потока;
- q3 – третий квартиль значение разброса величины потока;
- max – максимум значение разброса величины потока;
- iqr – межквартильное расстояние значений разброса величины потока;
- range – разброс значений разброса величины потока.
В нулевой кластер DBSCAN всегда складывает выбросы, видно что в эту группу попали реакции, составляющие крайний правый кластер на графике. Как и ожидалось первый кластер содержит почти 300 реакций, разброс значений потоков которых близок к нулю. Однако, сюрпризом является наличие еще 11 кластеров, содержащих реакции, разброс значений потоков которых практически совпадает, однако не равен нулю.
Проще всего разобраться с кластером 2 (на рисунке ниже), это набор реакций, поток через которые изменяется во всем диапазоне, но никогда не меняет направление. Они никак не скоррелированы ни между собой ни со скоростью производства биомассы.
Третий кластер уже гораздо интереснее:
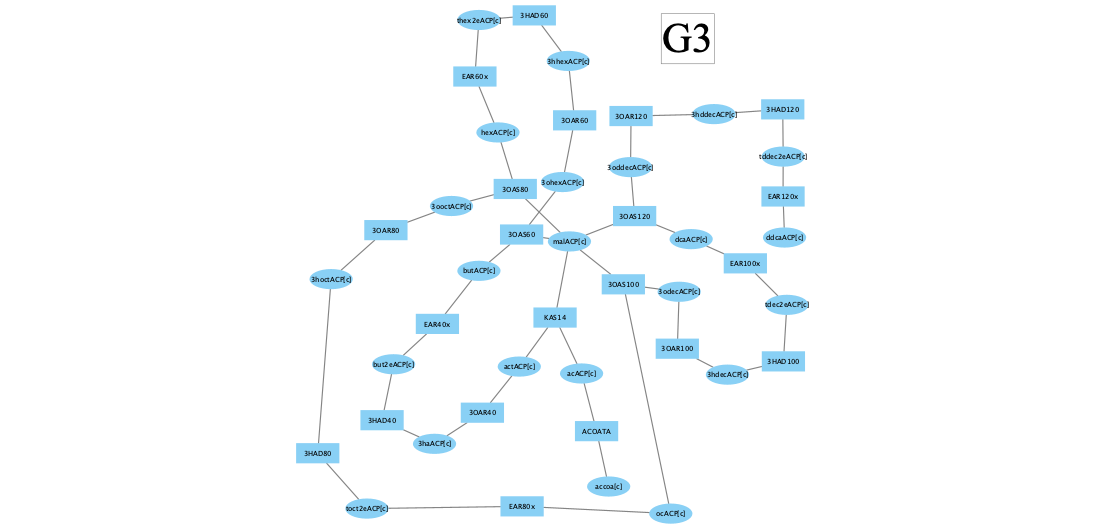
При более внимательном рассмотрении этот кластер содержит большую часть пути синтеза жирных кислот de novo с использованием ACP:

красный цвет и близкие к единице цифры возле реакций означают, что поток через реакции этого кластера сильно коррелирует со скоростью роста биомассы.
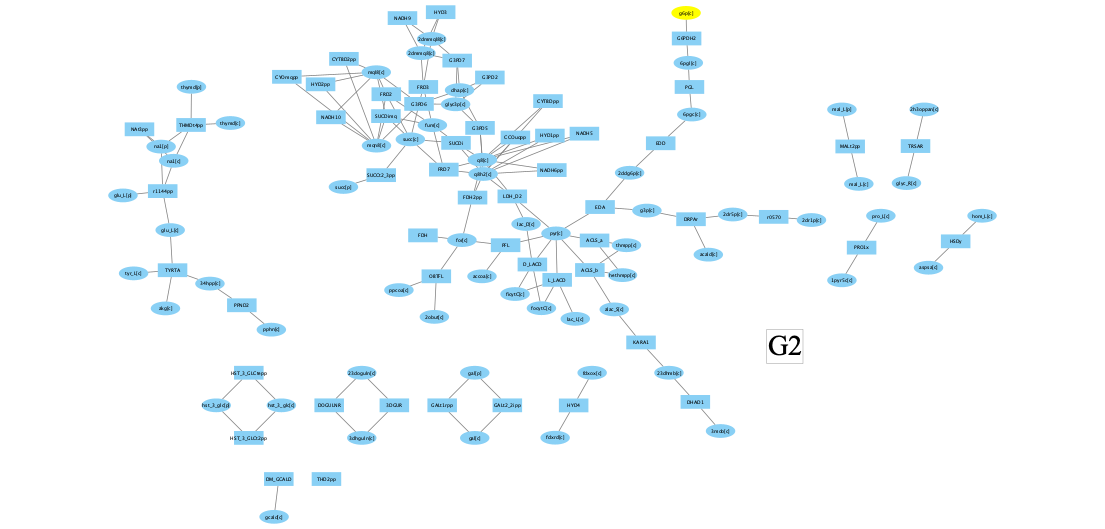
Четвертый кластер это большая часть пути бета-окисления жирных кислот: 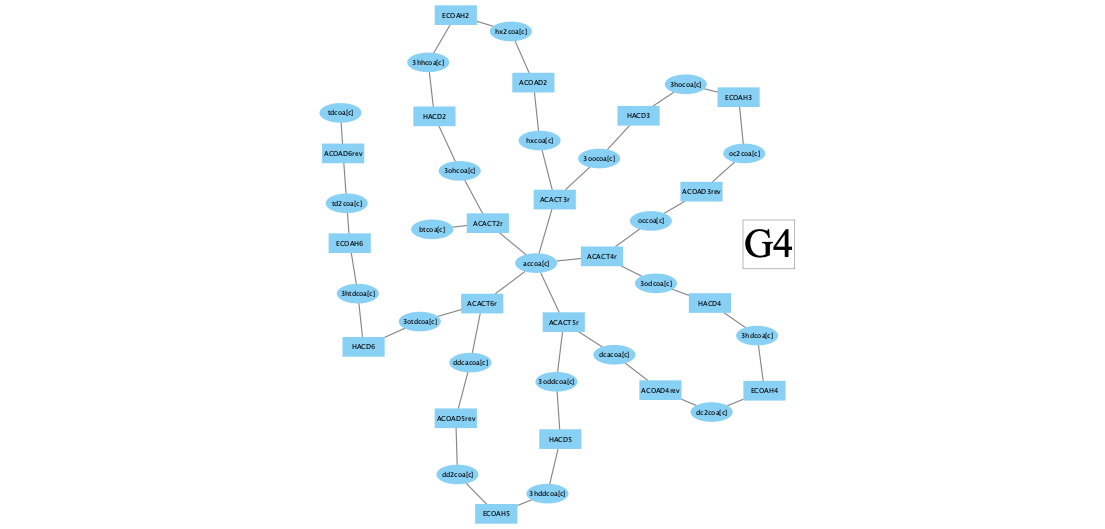
Если посмотреть как потоки в этом кластере коррелируют со скоростью роста биомассы: 
то видно, что уровень корреляции гораздо скромнее, чем в третьем кластере.
При первом взгляде на пятый кластер кажется что это набор несвязанных реакций: 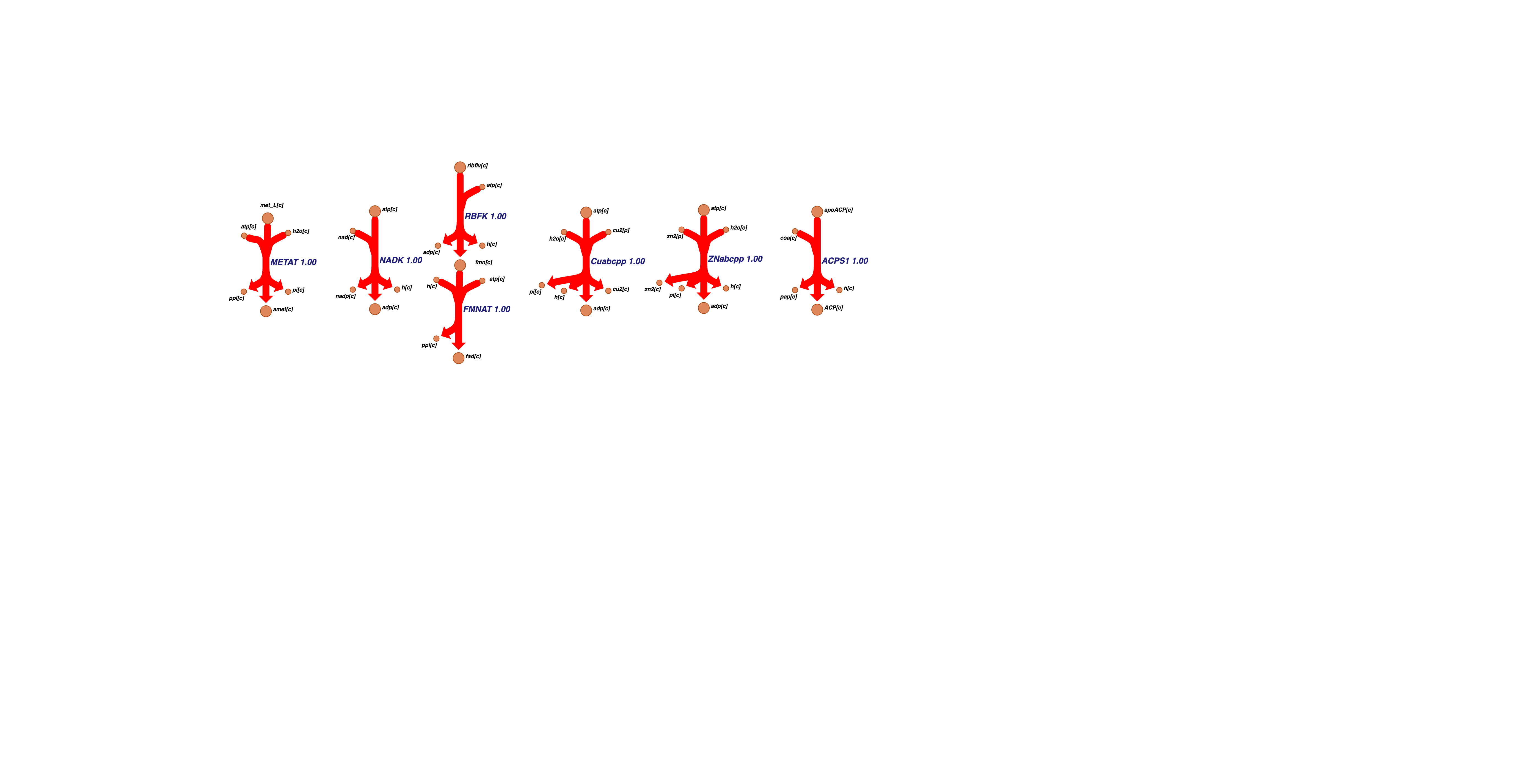
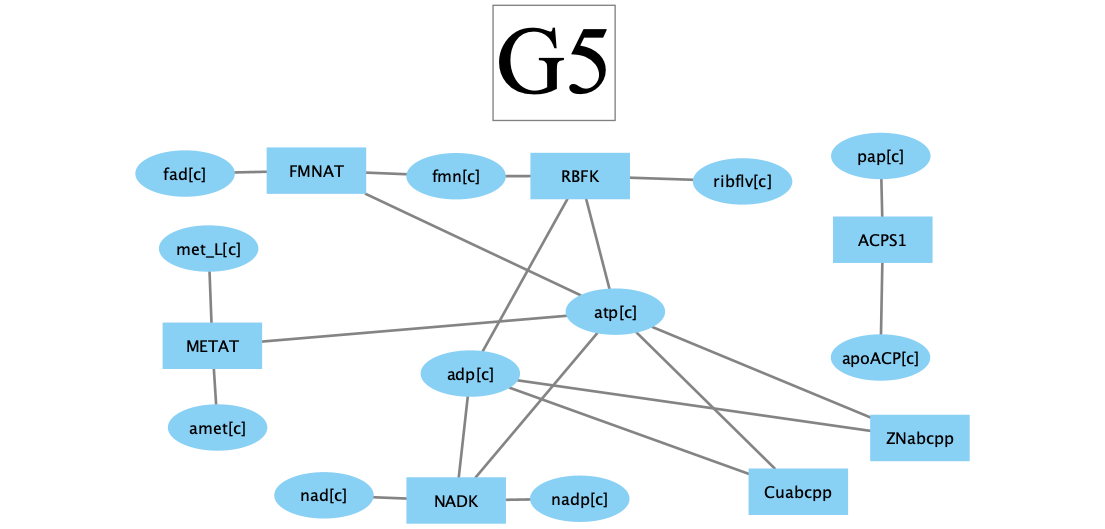
Хотя в другом представлении видно, что большинство реакций этого кластера собраны вокруг пары АТФ/АДФ, хотя причина разительного совпадения разбросов скоростей потока в этом кластере неочевидна.
Шестой кластер содержит значительную часть реакций метаболизма тиамина: 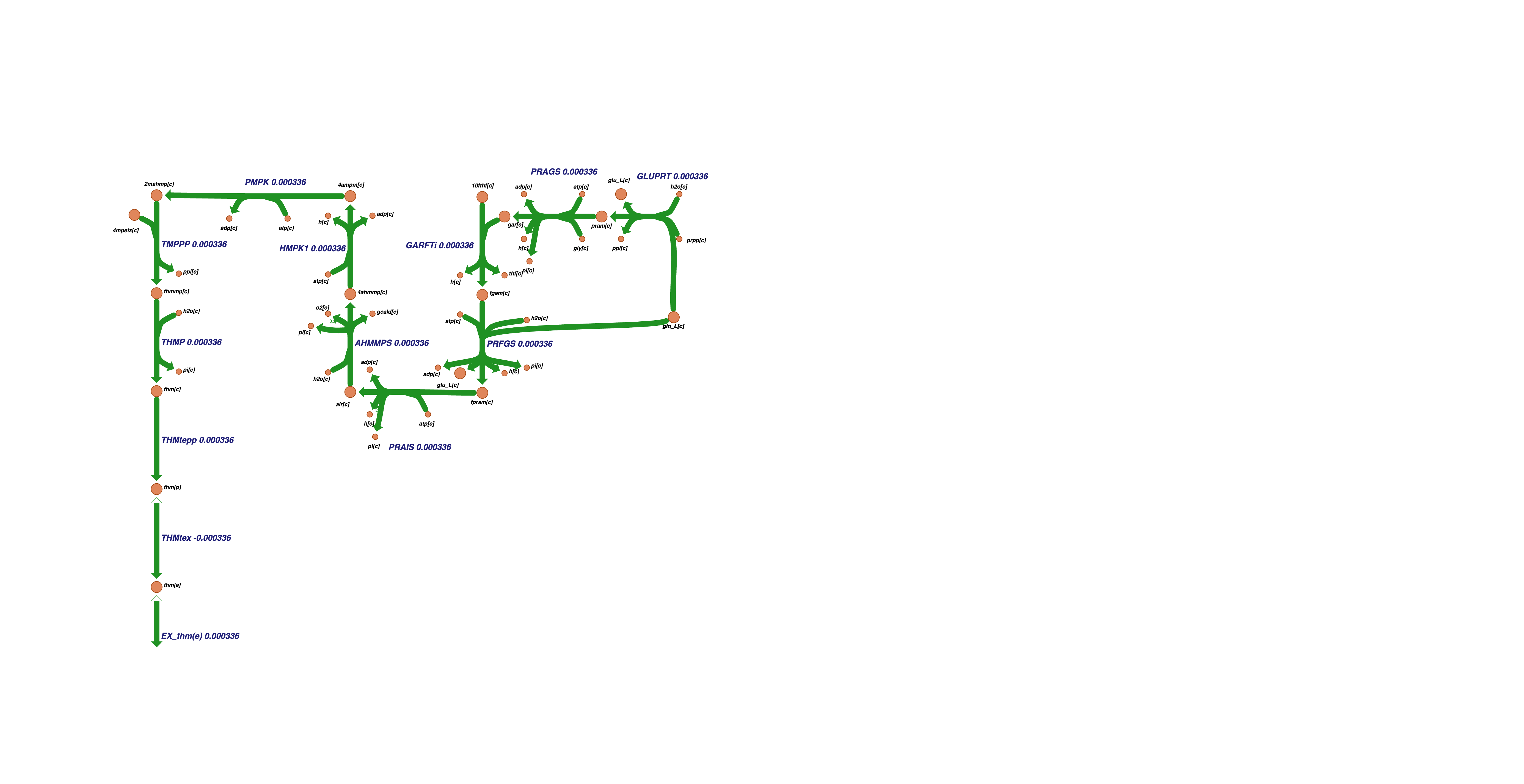
А седьмой – гистидина: 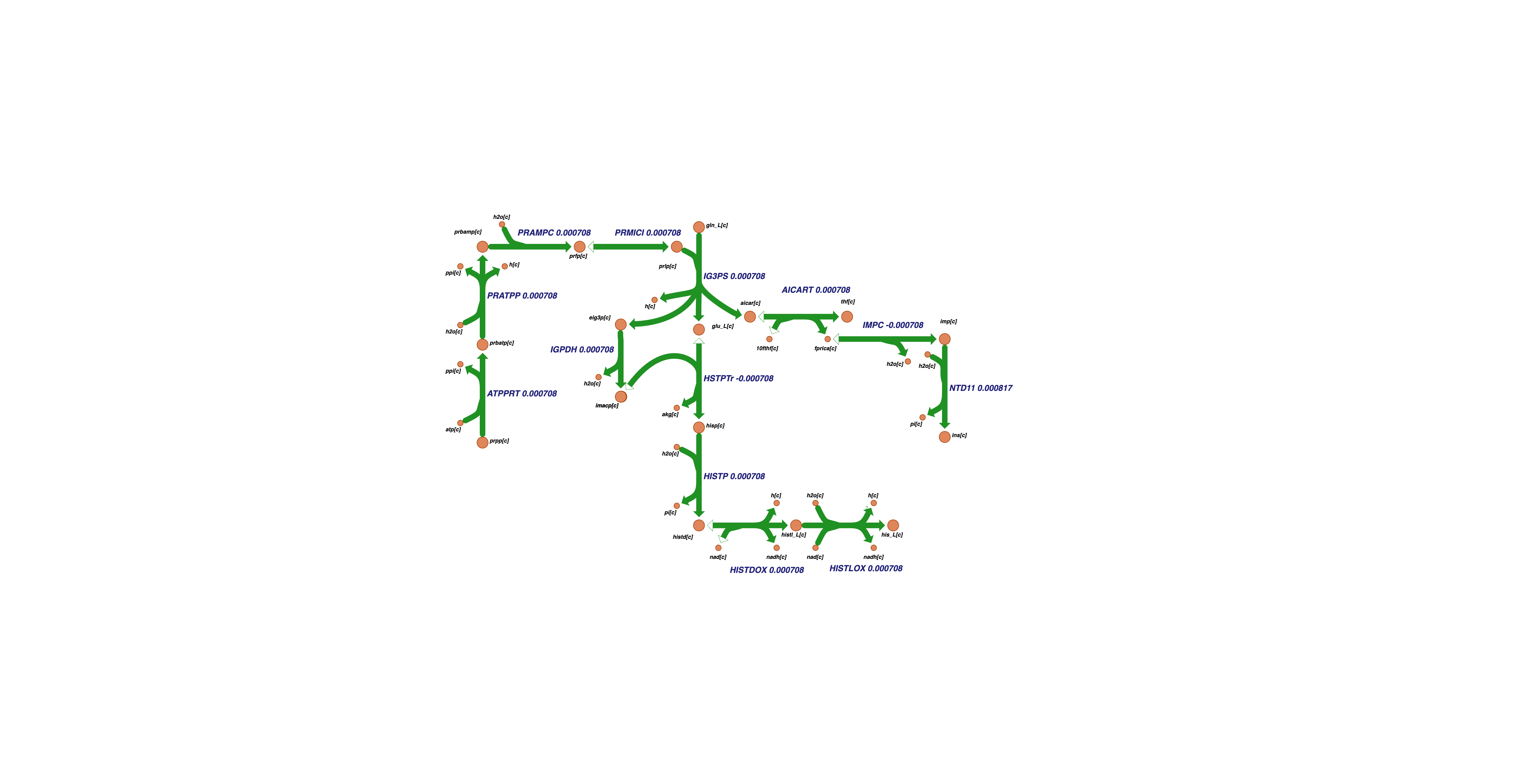
и оба эти кластера практически не коррелируют со скоростью роста биомассы.
Восьмой кластер: 
связан с подсистемой синтеза клеточной стенки, и, следовательно, сильно коррелируют со скоростью роста биомассы.
Девятый кластер содержит реакции метаболизма терпеноидов: 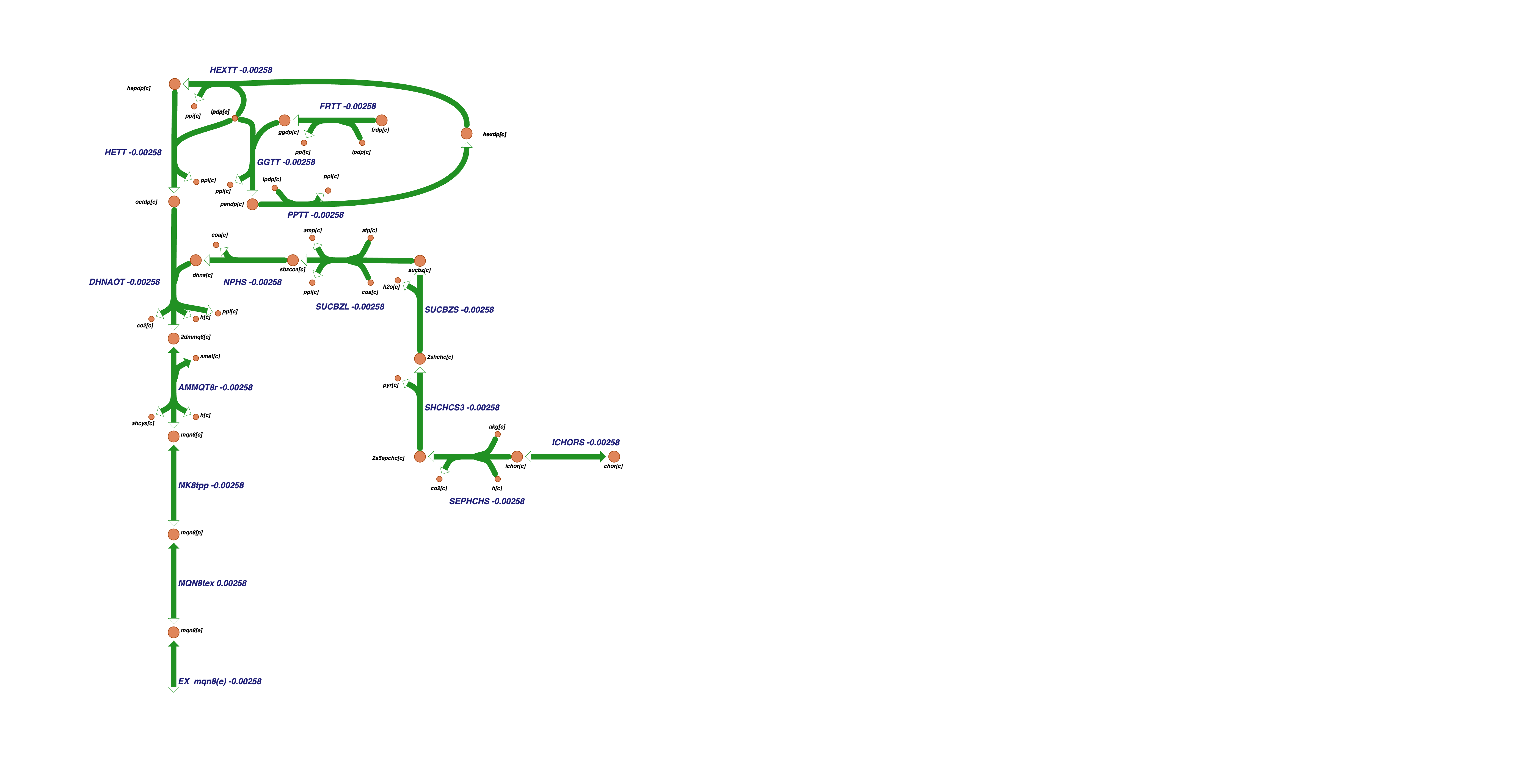
А десятый липополисахаридов: 
как и двенадцатый, 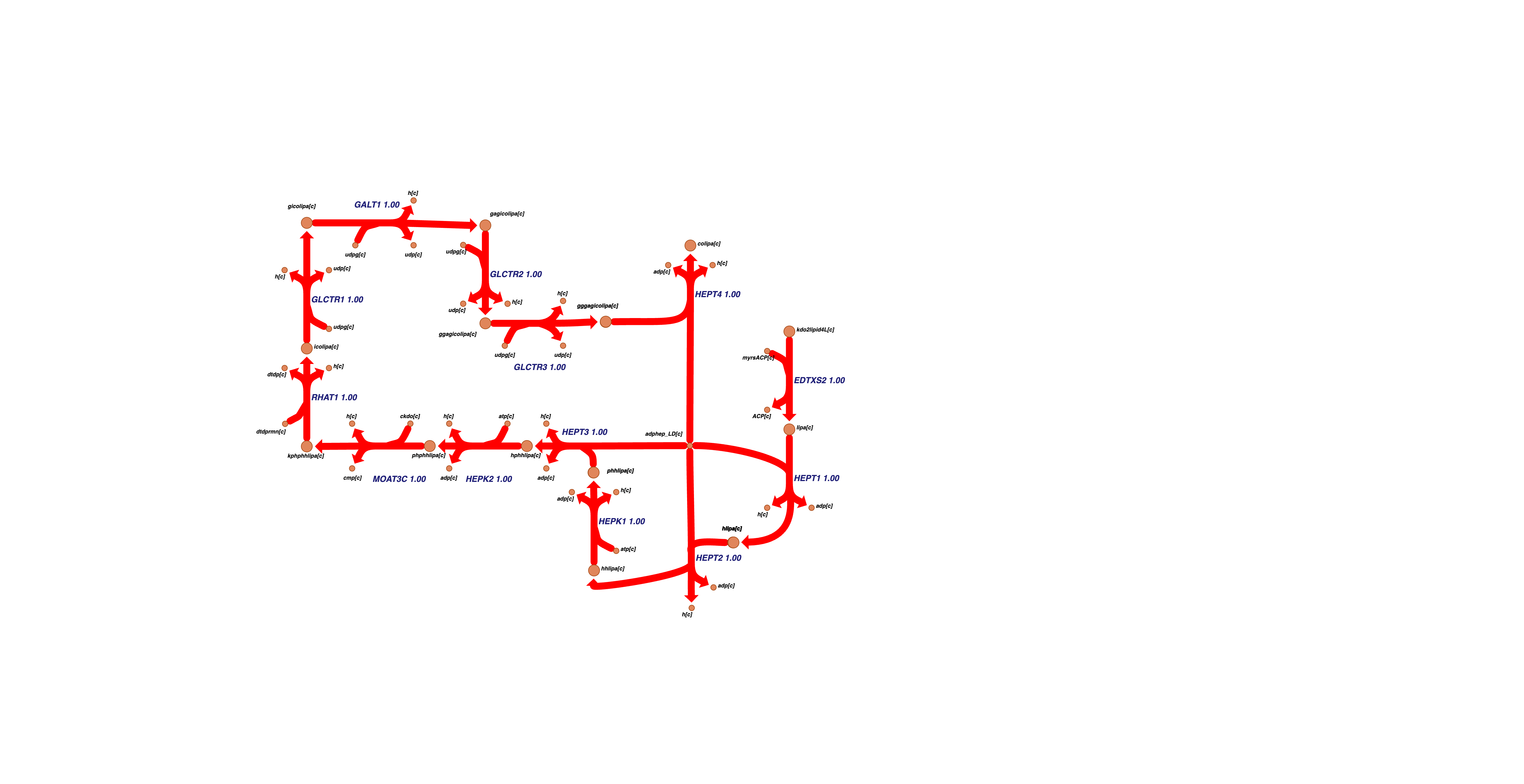
а разница в два раза между значениями разброса в этих кластерах, как и 100% корреляция между значениями потоков в 500К вычисленных решениях говорит о том что это один кластер разделенный из-за стехиометрии.
Последний, одиннадцатый кластер содержит реакции подсистемы биосинтеза кофермента А: 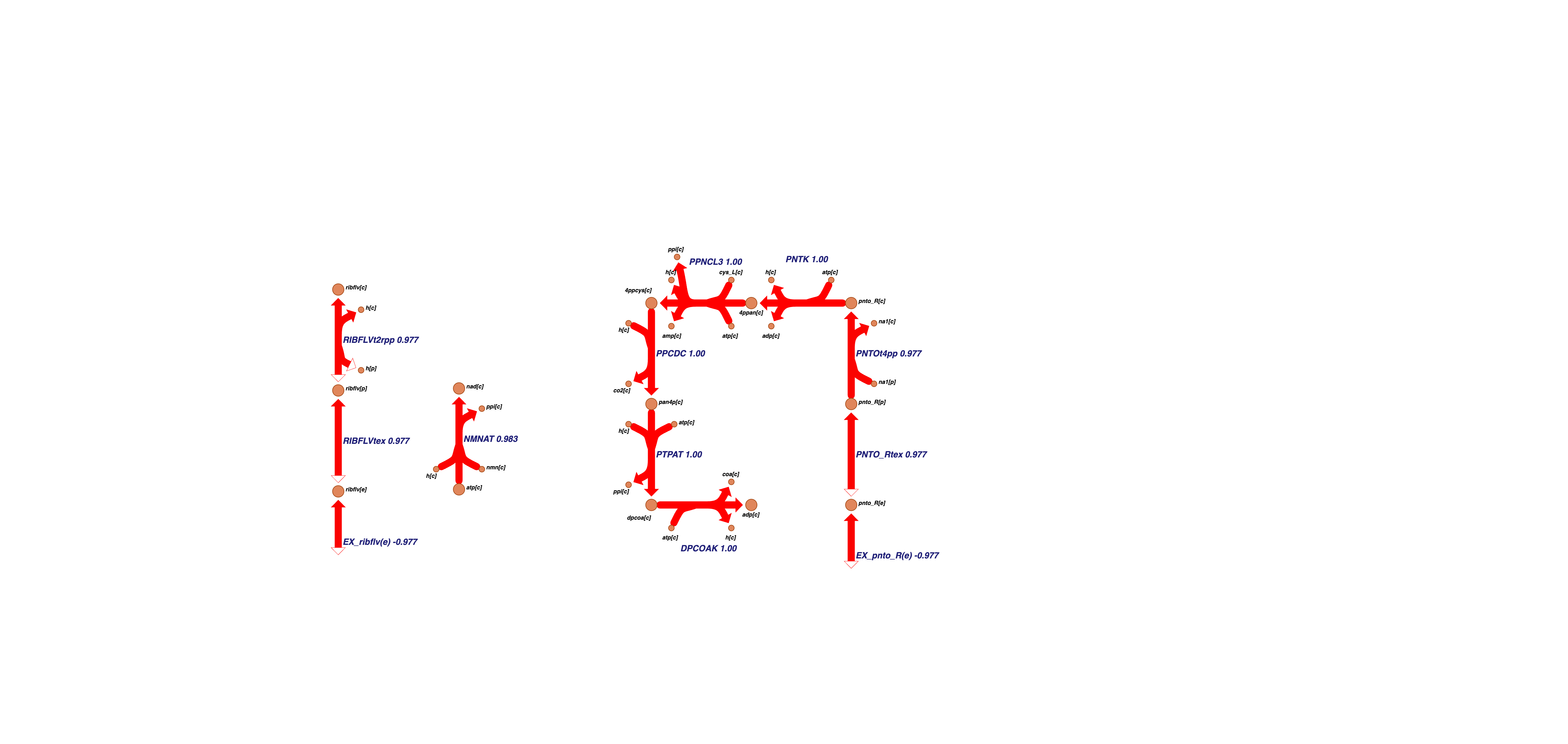
Полученная картина выглядит достаточно странно: почти половина реакций модели заблокирована во всех средах (наборах ограничений на величину потока реакций обмена) остается заблокированной. При этом только 8.3% всех реакций (кластер 1) можно считать обеспечивающими гомеостаз, еще 6.8% реакций (кластеры со второго по двенадцатый) демонстрируют стабильность разброса величины потока, хотя и характеризуются отличным от нуля величиной разброса.